Próteses ou implantes continuam a ser um risco por falta de segurança
Alguns dispositivos médicos implantados no corpo dos pacientes, como pacemakers, próteses de anca e joelho, implantes mamários, cateteres, entre outros, estão a ser denunciados como perigosos, segundo a Associação Defesa do Consumidor (DECO).
DOENÇAS E TRATAMENTOS
NOVOS VÍRUS, NOVAS PANDEMIAS? - Roteiros do medo
Ciclicamente, a humanidade tem sido confrontada com epidemias de origem infeciosa que rapidamente ficam fora de controle, transformando-se em pandemias. LER MAIS
Uma investigação realizada em 36 países, pelo International Consortium of Investigative Journalists, revela alertas de segurança e recolha de dispositivos médicos que apresentaram algum problema de segurança para a saúde pública ou do doente.
Em Itália, por exemplo, no ano passado, mais de 30 mulheres recorreram à Altroconsumo - uma associação que apoia o consumidor naquele país - para obter ajuda no pedido de indemnização relativo a efeitos secundários graves devido ao uso do dispositivo de contraceção permanente Essure, cuja produção foi, entretanto, suspensa pela [url-nolink=/pt/medicamentos/laboratorios/bayer-portugal-lda/informacao-geral]Bayer[/url].
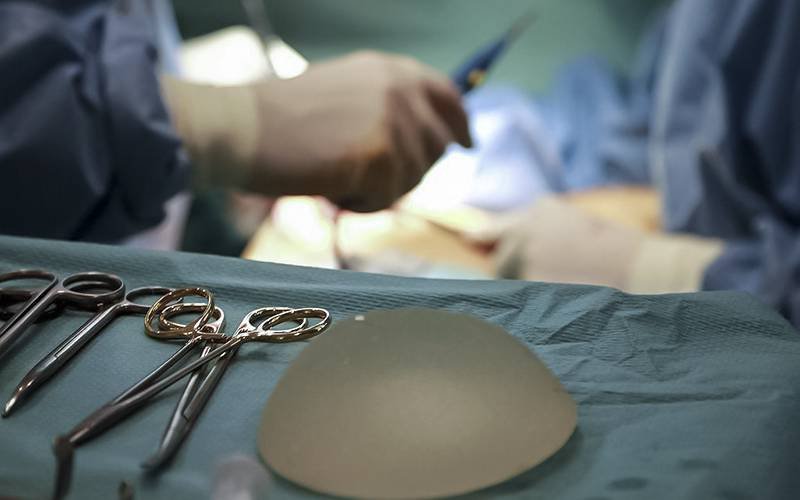
Portugal não está na lista atual das denúncias, mas, em 2012, as polémicas com os implantes mamários PIP - que afetaram várias portuguesas - e as próteses de metal na anca mostravam as fragilidades da lei dos dispositivos médicos na Europa.
Na altura, várias consumidoras portuguesas substituíram os implantes mamários da marca PIP devido a ruturas. “Temos defendido o reforço da avaliação dos dispositivos antes de serem colocados à venda, com maiores exigências nas provas científicas dos seus benefícios e riscos. Na nossa opinião, estes estudos devem ser acessíveis também ao público”, diz a DECO.
Segundo a nova regulamentação europeia sobre dispositivos médicos, que entra em vigor em 2020, “só podem ser colocados no mercado os dispositivos que respeitem os requisitos previstos, quando corretamente disponibilizados, mantidos e utilizados de acordo com a finalidade a que se destinam”.
“Assim, antes de colocar o dispositivo médico no mercado europeu, o fabricante deverá sujeitá-lo a um processo de avaliação de conformidade com os requisitos previstos na lei para obtenção da marcação CE. Deve, ainda, elaborar a Declaração CE de Conformidade e notificar a autoridade competente onde está sediado ou todas as autoridades competentes onde disponibiliza o dispositivo”, explica a DECO.
As novas regras reforçam a vigilância dos dispositivos depois de colocados no mercado, melhoram a informação ao consumidor e a transparência. No entanto, falham a oportunidade de reforçar a avaliação da segurança e eficácia dos dispositivos antes de chegarem aos consumidores, adverte a associação.
“Consideramos que as novas regras não introduzem uma avaliação adequada antes da comercialização dos dispositivos de alto risco (por exemplo, pacemakers ou dispositivos intrauterinos que não libertem progestagénios), como solicitámos. Apenas reforçam as regras de vigilância aplicadas aos organismos independentes responsáveis pela avaliação de dispositivos médicos antes de estes poderem ser colocados no mercado”, afirma em nota de imprensa.
“Só determinados dispositivos de alto risco, como implantes, podem passar por uma verificação adicional dos especialistas antes de serem colocados à venda. Reivindicamos, por isso, um reforço dos testes de eficácia e segurança”, conclui a DECO.














